医疗大数据驱动的行业创新解决方案
基于真实世界数据,为医疗器械企业和医疗机构提供省钱、省时、省力的上市战略和临床研究服务
NMPA / CE / FDA 器械注册,也许你可以省下百万费用
欧盟CE认证
通过建立注册登记数据库,或利用等同比对,我们可以协助你尝试采用真实世界数据(RWD)证明产品的安全有效性。
器械国内注册
即使不在“免临床目录”中,我们也可以协助你尝试通过同品种比对的方式,利用临床文献和临床经验数据减免临床试验。
欧盟MDD换MDR
对于遗留器械,我们可以协助你利用真实世界数据(RWD),尝试获取欧盟MDR的认可,减免临床试验所需的时间和费用。
上市后合规
上市后的临床跟踪(PMCF)、不良事件分析等,都可以使用真实世界数据(RWD)提供有力证据,通过审批。
附条件上市
附条件上市的器械产品,如果可以收集到使用中的真实世界数据(RWD),就有机会顺利通过审批转为常规上市。
扩适应症
增加器械的适应症,通常需要做临床试验,但如果可以从真实世界数据(RWD)中获得证据,就能节省大笔费用。

用真实世界证据(RWE)节省注册成本
贝马医械云协助医疗器械企业规划一条“创新型注册路径”,利用真实世界数据,减免临床试验的沉重负担,有机会节约“数百万费用”和“数个月时间”,更快上市。
依托慢病防控数据库,数据完整、合规
贝马医械云数据源自慢病防控数据库,数据中心得到批准可向基层采集数据,并已获得人类遗传资源保藏资质。数据库覆盖全国26个省市,200余家医院,涵盖500余病种,千万级数据量。
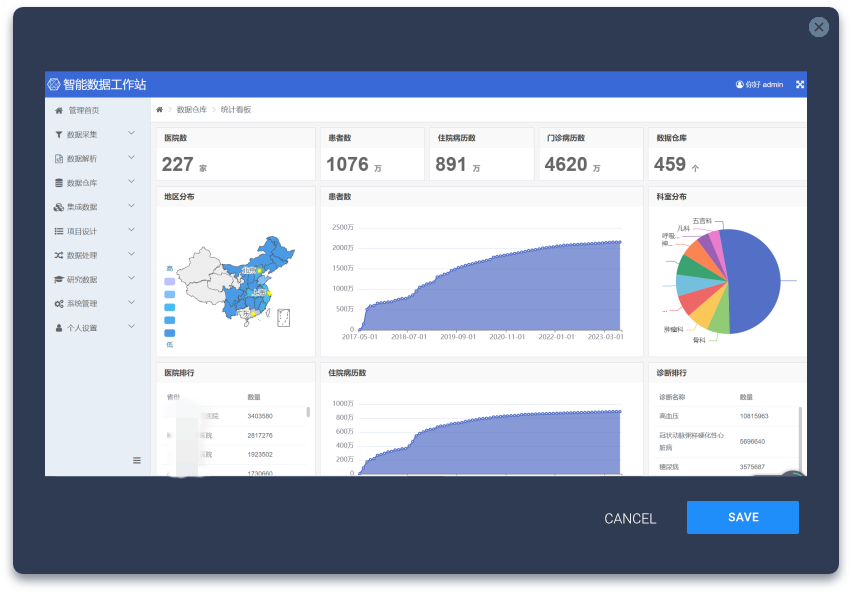
智能数据工作站,一站式完成数据治理
贝马医械云推出的从数据仓库到研究项目库的一站式数据工作站,帮助您轻松完成数据采集、数据治理、数据质控和数据的分析统计,为关键决策提供动力。
合作客户






价格对比
RCT
¥几百万
RWS
¥几十万
*此价格为大致的预估价格,具体价格以实际项目和贝马医械云商务团队评估为准。
